Membri del gruppo.
Prof. Gianantonio Battistuzzi, Dipartimento di Scienze Chimiche e Geologiche
Prof. Marco Borsari, Dipartimento di Scienze Chimiche e Geologiche
Progetti in corso.
Le idrogenasi sono una famiglia di metallo-proteine che catalizzano la riduzione degli ioni H3O+ presenti in soluzione acquosa a H2. Sfortunatamente, l’elevata sensibilità all’ossigeno molecolare, l’instabilità strutturale e le difficoltà di over-espressione ne hanno impedito l’utilizzo per la produzione su larga scala di idrogeno verde. In alternativa, sono stati sintetizzati complessi organometallici, i quali, pur superando le criticità delle idrogenasi, non hanno trovato applicazione nella produzione di larga scala di H2 a causa della solubilità in soluzioni acquose.
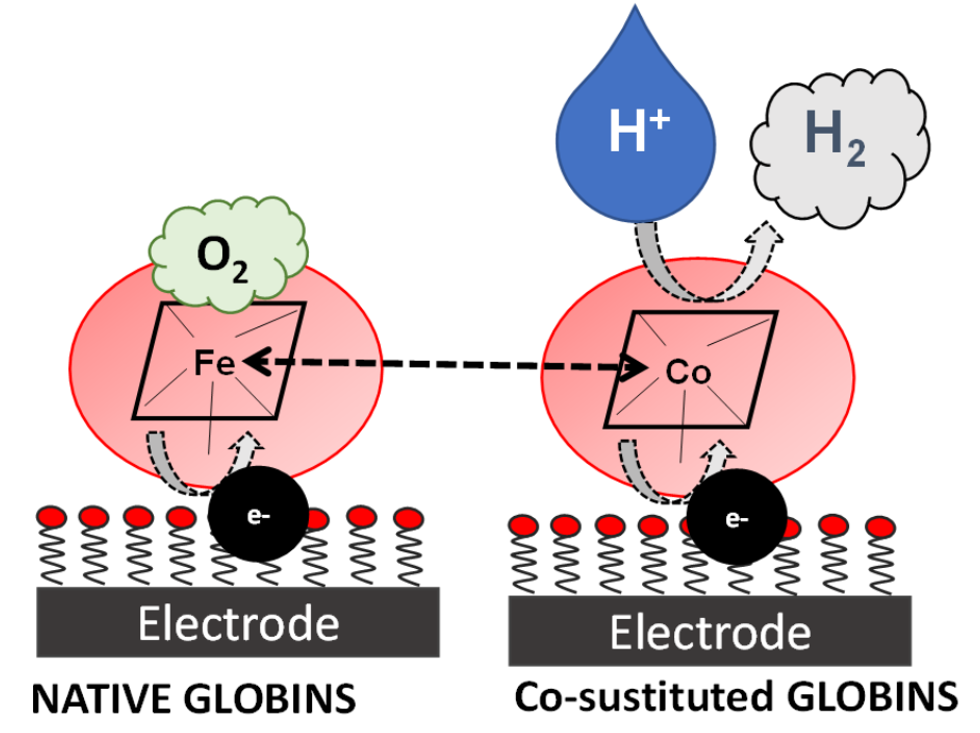
Negli ultimi dieci anni, l’incorporazione degli ioni Co(III)/Co(II) all’interno di matrici polipeptidiche si è rivelata una strada promettente verso la produzione di efficienti catalizzatori per la produzione di H2 verde, che uniscano una buona solubilità in soluzione acquosa ad una elevata resistenza all’azione dell’ossigeno atmosferico.
In questo ambito, il nostro gruppo di ricerca studia la possibilità di sviluppare nuovi enzimi ricombinanti in grado di mediare la riduzione elettrocatalica di H3O+ a H2, ottenuti sostituendo il gruppo eme (Fe-protoporfirina IX) presente in due globine umane (mioglobina e neuroglobina) con la Co-protoporfirina IX. Il progetto prevede la produzione di proteine Co-sostituite sia native che contenenti mutazioni selezionate, le cui capacità bioelettrocatalitiche verranno studiate con metodi elettrochimici, operando sia in soluzione che in seguito all’immobilizzazione sulla superficie elettrodica. Si prevede inoltre di inserire nella matrice proteica Co-porfirine che presentino sostituenti all’anello differenti rispetto a quelli della protoporfirina IX.
Competenze e Strumentazione
Il gruppo di ricerca possiede le seguenti competenze:
Produzione e isolamento di metalloproteine e metalloenzimi nativi e ricombinanti.
Caratterizzazione elettrochimica e spettroelettrochimica della reattività redox di metalloproteine e metalloenzimi in soluzione e immobilizzati su superfici elettrodiche.
Caratterizzazione delle proprietà strutturali ed elettroniche metalloproteine e metalloenzimi mediante differenti tecniche spettroscopiche (spettroscopia elettronica, dicroismo circolare e dicroismo circolare magnetico, emissione di fluorescenza, spettroscopia vibrazionale).
Management di progetti di ricerca multidisciplinari.
Pubblicazioni recenti.
S. Casalini, G. Battistuzzi, M. Borsari, C. A. Bortolotti, A. Ranieri, M. Sola “Electron Transfer and Electrocatalytic Properties of the Immobilized Methionine80Alanine Cytochrome c Variant”, J. Phys. Chem. B, 2008, 112; 1555-1563.
S. Casalini, G. Battistuzzi, M. Borsari, A. Ranieri, M. Sola “Catalytic reduction of dioxygen and nitrite ion at a Met80Ala Cytochrome c – functionalyzed electrode”, J. Am. Chem. Soc., 2008, 130, 15099-15104.
S. Casalini, G. Battistuzzi, M. Borsari, C. Bortolotti, G. Di Rocco, A. Ranieri, M. Sola “Electron Transfer Properties and Hydrogen Peroxide, Electrocatalysis of Cytochrome c Variants at Positions 67 and 80”, J. Phys. Chem. B, 2010, 114, 1698–1706.
Ranieri, D. Millo, G. Di Rocco, G. Battistuzzi, C. A. Bortolotti, M. Borsari, M. Sola, “Immobilized Cytochrome c Bound to Cardiolipin Exhibits Peculiar Oxidation State-Dependent Axial Heme Ligation and Catalytically Reduces Dioxygen”, J. Biol. Inorg. Chem. 2015, 20, 531-540.
Schaffner, G. Mlynek, F. Nicola, D. Puehringer, J. Libiseller-Egger, L. Coates, S. Hofbauer, M. Bellei, P. Furtmüller, G. Battistuzzi, G. Smulevich, K. Djinovic-Carugo, C. Obinger “Molecular mechanism of enzymatic chlorite detoxification: insights from structural and kinetic studies”, ACS Catalysis 2017, 2017, 7, 7962-7976.
Ranieri, C. A. Bortolotti, G. Di Rocco, G. Battistuzzi, M. Sola, M. Borsari Electrocatalytic Properties of Immobilized Heme Proteins: Basic Principles and Applications, ChemElectroChem. 2019, 6, 5172–5185.
L. Lancellotti, M. Borsari, A. Bonifacio, C. A. Bortolotti, G. Di Rocco, S. Casalini, A. Ranieri, G. Battistuzzi, M. Sola Adsorbing surface strongly influences the pseudoperoxidase and nitrite reductase activity of electrode-bound yeast cytochrome c. The effect of hydrophobic immobilization, Biolectrochemistry, 2020, 136, 107628.
L. Lancellotti, M. Borsari, M. Bellei, A. Bonifacio, C. A. Bortolotti, G. Di Rocco, A. Ranieri, M. Sola, G Battistuzzi Urea-induced denaturation of immobilized yeast iso-1 cytochrome c: role of Met80 and Tyr67 in the thermodynamics of unfolding and promotion of pseudoperoxidase and nitrite reductase activities, Electrochim. Acta, 2020, 363, 137237.
G. Di Rocco, B. Bighi, M. Borsari, C. A. Bortolotti, A. Ranieri, M. Sola, G. Battistuzzi Electron Transfer and Electrocatalytic Properties of the Immobilized Met80Ala Cytochrome c Variant in DMSO, ChemElectroChem, 2021, 8, 2115–2123.
Ranieri, M. Borsari, S. Casalini, G. Di Rocco, M. Sola, C. A. Bortolotti, G. Battistuzzi How to Turn an Electron Transfer Protein into a Redox Enzyme for Biosensing, Molecules, 2021, 26, 4950.